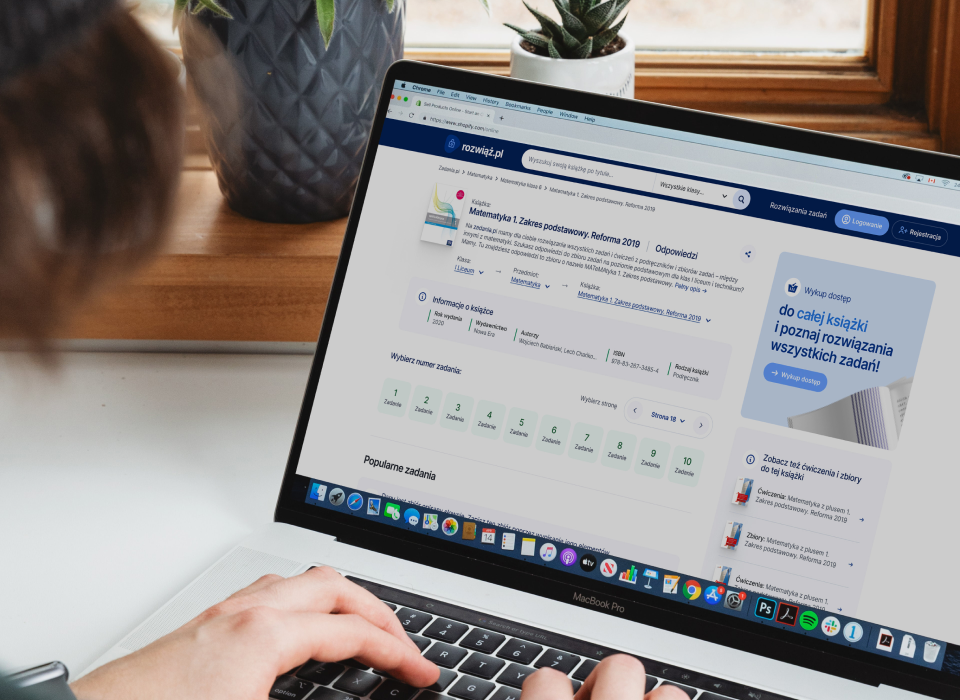
Rozwiązania zadań z chemii






Ciekawa chemia 8 Podręcznik

Ciekawa chemia 8 Zeszyt ćwiczeń

Świat chemii 8 Podręcznik

Świat chemii 8 Zeszyt ćwiczeń

Świat chemii 7 Podręcznik

Ciekawa chemia 7 Zeszyt ćwiczeń

Ciekawa chemia 7 Podręcznik

Świat chemii 7 Zeszyt ćwiczeń





Chemia 7 i 8 Zbiór zadań

Chemia 7 i 8 Zbiór zadań

Chemia. Klasa 1. Podręcznik. Zakres podstawowy – rozwiązania i odpowiedzi Podręcznik

Zbiór zadań z chemii dla liceów i techników. Zakres rozszerzony Zbiór zadań

Chemia 3. Zakres rozszerzony Podręcznik
Ostatnio przygotowane rozwiązania z Chemia

Lista rozwiązanych zadań
Proces krystalizacji substancji stałej może nastąpić tylko z roztworu
Proces krystalizacji substancji stałej może nastąpić tylko z roztworu
Po ogrzaniu roztworu tlenu w wodzie od temperatury 20°C do 40°C
Po ogrzaniu roztworu tlenu w wodzie od temperatury 20°C do 40°C
Podczas rozpuszczania substancji stałych w rozpuszczalnikach ciekłych podwyższenie temperatury rozpuszczalnika

Lista rozwiązanych zadań
Odszukaj (w dostępnych Ci źródłach informacji) nazwy co najmniej trzech monosacharydów, które mają ten sam wzór sumaryczny co glukoza i fruktoza.
W wyniku hydrolizy sacharozy otrzymano 45 g glukozy. Oblicz, ile gramów fruktozy powstało w tej reakcji oraz ile gramów sacharozy użyto do tej reakcji.
Wykonaj doświadczenie w domu:
Wyjaśnij, dlaczego osobie, która spożyła toksyczne metale ciężkie, należy natychmiast podać produkty zawierające białka, np. mleko lub kurze jaja.
Oblicz wzór sumaryczny monosacharydu o masie cząsteczkowej 150 u, jeżeli wiesz, że procentowa zawartość masowa węgla w cząsteczce tego cukru wynosi 40%, a stosunek ilości atomów wodoru do ilości atomów węgla w cząsteczce wynosi 2:1.

Lista rozwiązanych zadań
Na dolnych częściach szalek Petriego umieszczono odpowiednio: na pierwszej – próbkę skrobi, a na drugiej – próbkę celulozy. Zaprojektuj doświadczenie pozwalające odróżnić te dwa związki. Podaj niezbędny sprzęt i odczynniki. Narysuj schemat, podaj obserwacje i wyciągnij wniosek.
Opisz właściwości fizyczne glukozy i fruktozy. Zapisz wynikające z nich zastosowania.
Opisz właściwości fizyczne sacharozy. Zapisz wynikające z nich zastosowania.
Powiedz, które z podanych poniżej związków chemicznych należą do cukrów prostych, a które – do cukrów złożonych. Zapisz dla każdego wzór sumaryczny.glukoza sacharoza celuloza fruktoza skrobia
Podaj czynniki, które powodują denaturację i koagulację białek. Wyjaśnij znaczenie tych pojęć.

Lista rozwiązanych zadań
Skład chemiczny skrobi i celulozy można przedstawić za pomocą wzoruogólnego:A. CnH₂nOnB. C6H12O6C. (CnH2nOn)mD. (C6H10O5)n
Celuloza — jeden z wielocukrów — stanowi :A. materiał zapasowy roślin.B. materiał zapasowy zwierząt. C. materiał budulcowy roślin. D. materiał budulcowy zwierząt.
Celuloza jest jednym z podstawowych surowców w przemyśle:A. spożywczym. B. włókienniczym.C. petrochemicznym.D. farmaceutycznym.
Skład chemiczny skrobi i celulozy można przedstawić za pomocą wzoruogólnego:A. CnH₂nOnB. C6H12O6C. (CnH2nOn)mD. (C6H10O5)n
Obecność skrobi można wykryć za pomocą A. roztworu jodu w alkoholu etylowym.B. reakcji biuretowej.C. reakcji ksantoproteinowej. D. reakcji z wodorotlenkiem miedzi (II).

Odpowiedzi do zadań z chemii
Rozwiązywanie zadań z chemii online to także doskonały sposób, by sprawdzić, ile już wiesz. Przeglądaj odpowiedzi, poznawaj rozwiązania do konkretnych poleceń i określ, który materiał nie wymaga już powtórzenia, a nad którym musisz jeszcze popracować. W ten sposób zaplanujesz swoje przygotowania do sprawdzianu, ale także ważnych egzaminów.
Twoją szkolną zmorą jest chemia? Odpowiedzi do zadań pomogą Ci ją zrozumieć. Często uczniowie posiadają potrzebną wiedzę, ale nie potrafią zrozumieć polecenia. Sprawdzając na naszej stronie rozwiązania, możesz utrwalić formy poleceń i połączyć je z konkretnymi odpowiedziami. Nawet najtrudniejsze zadanie domowe czy praca klasowa nie zestresują Cię, bo w kilka chwil będziesz wiedzieć, jak rozwiązać to zagadnienie. Już dziś poznaj stronę odpowiedzi.pl i sprawdź, jak przyjemna może okazać się nauka chemii.